|
NanoPro 1000信号转导蛋白磷酸化分析系统
在细胞生物学功能研究中,有许多常规的研究手段,如流式,生物质谱,双向电泳,蛋白芯片等技术。随着研究的深入,科学家们特别需求进行真正意义上的高灵敏,高精度研究手段,力求通过一次实验,快速发现更多的信息:鉴定结果更为可信,灵敏度更加提高来鉴定更多低丰度蛋白,更多的修饰信息,结构信息等。传统分析技术具有很多局限性,如双向凝胶电泳(2DE),对疏水性蛋白、碱性蛋白、特别是低丰度蛋白等无能为力,成为蛋白质组研究的瓶颈;而质谱分析技术也是由于灵敏度等问题,需要大量的样品等原因,十几年来一直对研究低丰度调控蛋白缺乏信心.
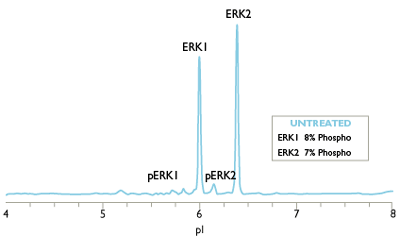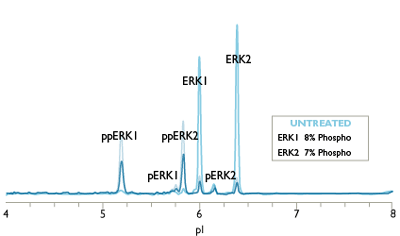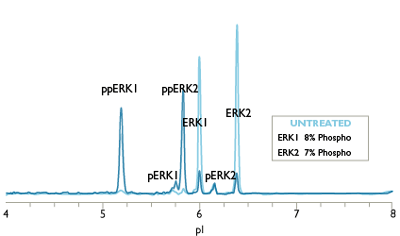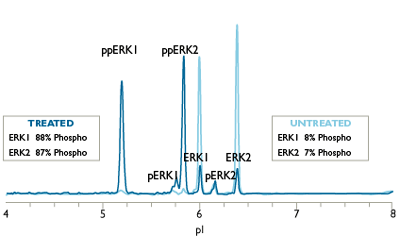
相同的Western, 不同的生物学实验结果
另外, 传统蛋白分析技术所用的蛋白量需来自成千上万个细胞。所得结果分辨率及重复性不理想。各种蛋白分析法所需样品量如下:
1.质谱仪样品量100000 个细胞
2.细胞仪样品量:10000 个细胞
3蛋白电泳,样品量:5000 个细胞
4.蛋白芯片样品量:1000个细胞
ProteinSimple公司的NanoPro1000超微量蛋白分析系统为蛋白功能和信号通路研究提供了一个全新的研究方案。传统的蛋白研究方法需要成千上万的细胞,而NanoPro 1000系统每次分析仅需要25个细胞。
并可对超微量珍贵样品的信号转导蛋白之特性直接检测,适用各种样品包括:
1.原代细胞
2.FACS 分选细胞
3.穿刺抽取之肿瘤细胞
4.显微切片组织细胞
5.分离的干细胞群
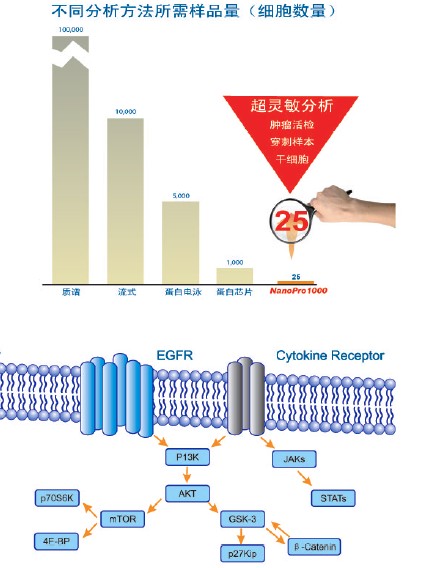
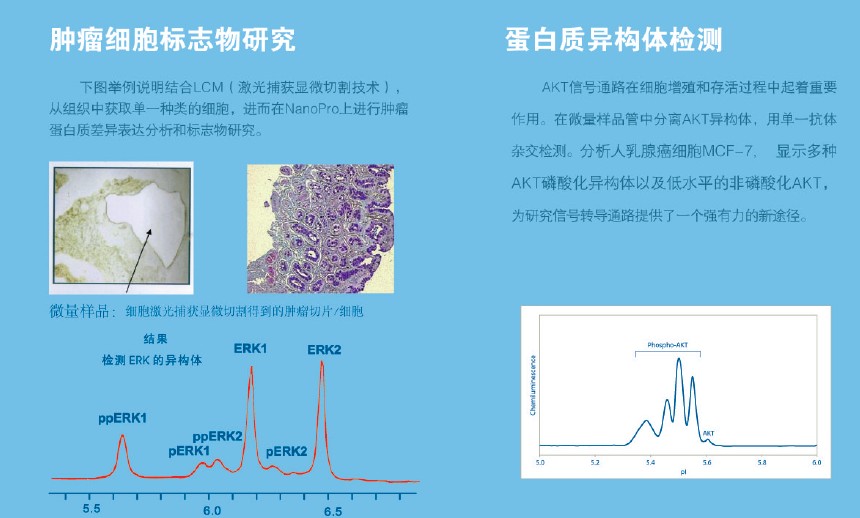
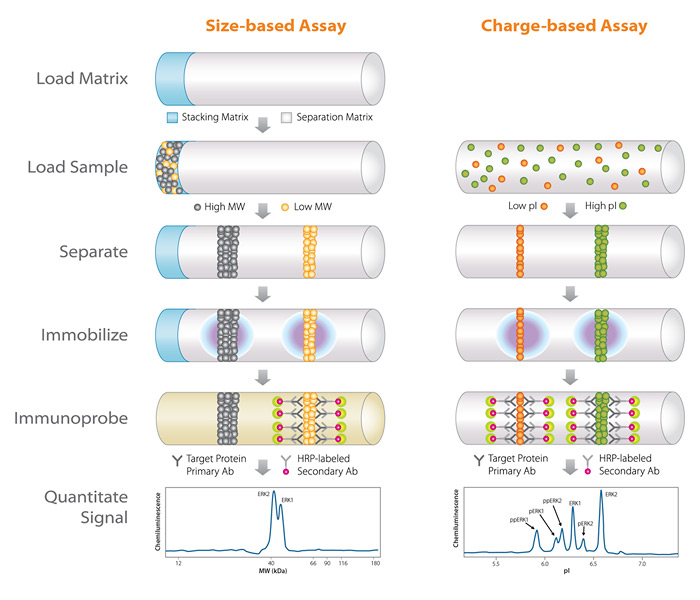
NanoPro系统利用专利的毛细管样品定位及分析技术,结合毛细管分离及化学发光检测原理进行纳米级的自动化实验,避免了人为操作误差,有效提高检测结果的精确性和重复性。过去蛋白检测仪无法检测到的信息,如细胞内控制通路的调控信息,可由此精确测得。
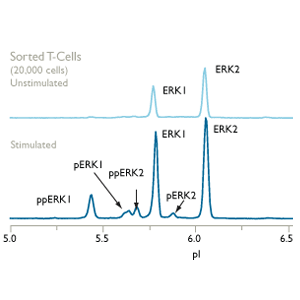
NanoPro技术被用来分析信号转导过程中所涉及的蛋白构象上的极细微变化。NanoPro1000为结构紧凑的台式分析系统。
从新的角度分析蛋白调控机制,NanoPro技术采用等电点电泳的方法将不同构象的蛋白分离。该方法大大推进了多个领域的研究,包括:
药物开发-筛选激酶抑制剂药物的作用靶点
生物标记物的发现和确认-观察疾病引起的蛋白构象的细微变化,研究其发病机制
肿瘤蛋白活性-研究组织和细胞中肿瘤蛋白的调控机制翻译后修饰的研究-检测蛋白构象改变引起的等电点极细微的变化
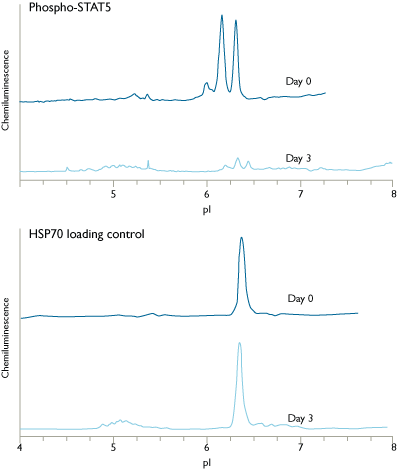
NanoPro 1000将蛋白分离与检测技术相结合:
NanoPro将毛细管等电点电泳和化学发光免疫测定这两种常用的蛋白检测技术相结合。等电点电泳可将不同构象的蛋白分离。分离后蛋白被仪器固定在毛细管壁上,接着用化学发光免疫的方法检测蛋白。这为信号转导蛋白的检测提供了新的视角。
【操作流程】
1.上样
每个毛细管中加400nl样本混合物,包括样本、荧光标记PI和两性电解质。
2.分离
毛细管两端加电压,样本中的蛋白质随着自身等电点的不同,加以分离。
3.固定
毛细管在紫外光照射下,其毛细管壁上的专利化学物质被激活,从而将分离的蛋白异构体固定在毛细管壁上。
4.免疫标记
用洗脱液将非特异结合的蛋白质洗脱,将固定的蛋白质进行免疫反应,加入发光催化剂诱导其化学发光,发光信号被CCD摄像机拍摄下来。
5.结果分析
通过专业的软件,对结果进行定量分析
应用:
Post-Translational Modification Characterization
发表文献:
- The F-BAR protein PACSIN2 regulates epidermal growth factor receptor internalization
Bart-Jan de Kreuk, Eloise C. Anthony, Dirk Geerts and Peter L. Hordijk
JBC, Nov 2012; published as manuscript
- ERBB3 (HER3) is a key sensor in the regulation of ERBB-mediated signaling in both low and high ERBB2 (HER2) expressing cancer cells
Byung-Kwon Choi, Xuejun Fan, Hui Deng, Ningyan Zhang, Zhiqiang An
Cancer Med, Aug 2012; 1(1): 28-31
- VEGFR2 induces c-Src signaling and vascular permeability in vivo via the adaptor protein TSAd
Zuyue Sun, Xiujuan Li, Sara Massena, Simone Kutschera, Narendra Padhan, Laura Gualandi, Vibeke Sundvold-Gjerstad, Karin Gustafsson, Wing Wen Choy, Guangxiang Zang, My Quach, Leif Jansson, Mia Phillipson, Md Ruhul Abid, Anne Spurkland, and Lena Claesso
J Exp Med, Jul 2012; 209(7):1363-77.
- Autocrine activation of the MET receptor tyrosine kinase in acute myeloid leukemia
Alex Kentsis, Casie Reed, Kim L Rice, Takaomi Sanda, Scott J Rodig, Eleni Tholouli, Amanda Christie, Peter J M Valk, Ruud Delwel, Vu Ngo, Jeffery L Kutok, Suzanne E Dahlberg,Lisa A Moreau, Richard J Byers, James G Christensen, George Vande Woude, Jonathan
Nat Med, Jul 2012; 18(7): 1118-1124
- Intermolecular Binding between TIFA-FHA and TIFA-pT Mediates Tumor Necrosis Factor Alpha Stimulation and NF-κB Activation
Chia-Chi Flora Huang, Jui-Hung Weng, Tong-You Wade Wei, Pei-Yu Gabriel Wu, Pang-Hung Hsu, Yu-Hou Chen, Shun-Chang Wang, Dongyan Qin, Chin-Chun Hung, Shui-Tsung Chen, Andrew H.-J. Wang, John Y.-J. Shyy and Ming-Daw Tsai
Mol Cell Biol, Jul 2012; 32(14): 2664-2673
- The Sin3a repressor complex is a master regulator of STAT transcriptional activity
Laura Icardi, Raffaele Mori, Viola Gesellchen, Sven Eyckerman, Lode De Cauwer, Judith Verhelst, Koen Vercauteren, Xavier Saelens, Philip Meuleman, Geert Leroux-Roels, Karolien De Bosscher, Michael Boutros, and Jan Tavernier
PNAS, Jul 2012; 109(30): 12058-12063
- Charge heterogeneity of monoclonal antibodies by multiplexed imaged capillary isoelectric focusing immunoassay with chemiluminescence detection
David A Michels, Andrea W Tu, Will McElroy, David Voehringer, and Oscar Salas-Solano
Anal Chem, May 2012; Just Accepted Manuscript, Publication Date (Web): May 23, 2012
- Pdx1 Is Post-Translationally Modified In vivo and Serine 61 Is the Principal Site of Phosphorylation
Thomas Frogne, Kathrine Beck Sylvestersen, Stefan Kubicek, Michael Lund Nielsen, Jacob Hecksher-Sørensen
PLoS One, Apr 2012; 7(4):e35233. Epub.
- Defining the role of TORC1/2 in multiple myeloma
Patricia Maiso, Yi Liu, Brittany Morgan, Abdel Kareem Azab, Pingda Ren, Michel B. Martin, Yong Zhang, Yang Liu, Antonio Sacco, Hai Ngo, Feda Azab, Phong Quang, Scott J. Rodig, Charles P. Lin, Aldo M. Roccaro, Christian Rommel, and Irene M. Ghobrial
Blood, Nov 2011; 118(26): 6860-6870
- The synthetic bryostatin analog Merle 23 dissects distinct mechanisms of bryostatin activity in the LNCaP human prostate cancer cell line
Noemi Kedei, Andrea Telek, Alexandra Czap, Emanuel S. Lubart, Gabriella Czifra, Dazhi Yang, Jinqiu Chen, Tyler Morrison, Paul K. Goldsmith, Langston Lim, Poonam Mannan, Susan H. Garfield, Matthew B. Kraft, Wei Li, Gary E. Keck, Peter M. Blumberg
Biochem Pharmacol, Jun 2011; 81(11): 1296-1308
- Nanofluidic proteomic assay for serial analysis of oncoprotein activation in clincal specimens
Alice C Fan, Debrabrita Deb-Basu, Mathias W Orban, Jason R Gotlib, Yasodha Natkunam, Roger ONeill, Rose-Ann Padua, Liwen Xu, Daryl Taketa, Amy E Shirer, Shelly Beer, Ada X Yee, David W Voehringer, Dean W Felsher
Nature Medicine, May 2009; Volume 15, Number 5: 566-571
- Isoelectric focusing technology quantifies protein signaling in 25 cells
Roger A ONeill, Arunashree Bhamidipati, Xiahui Bi, Debabrita Deb-Basu, Linda Cahill, Jason Ferrante, Erik Gentalen, Marc Glazer, John Gossett, Kevin Hacker, Celeste Kirby, James Knittle, Robert Loder, Catherine Mastroieni, Michael MacLaren, Thomas M
PNAS, Oct 2006; Volume 103, Number 44: 16153-16158
|
