2020年,关于抗新冠病毒COVID-19高效药物研发的新闻一直没有间断。老药和新药,调节机体免疫的和抑制病毒复制等……各种报道不断进入人们的视线。那么,问题来了,有没有一个平台能对药物的抗病毒效果进行高通量的评估,加速这一筛选进程呢?
接下来,给大家分享介绍下国际上应用Yokogawa CQ1高内涵筛选平台所取得的一些进展。
CQ1用于脂滴相关抗冠状病毒药物筛选
来自密歇根大学药物再利用中心的科学团队,基于生物成像,利用FDA已批准的药物库,通过SARS-CoV-2病毒感染HUH7肝癌细胞,检测脂滴的表达,检测病毒的核衣壳(病毒蛋白质衣壳和衣壳中心包含的病毒核酸的合称)表达,在Yokogawa CQ1高内涵分析系统上实现了抗COVID-19病毒药物的快速筛选。同时,结合CQ1的Cell Painting表型筛选和深度自学习功能,能够更深入理解感染的过程和感染机制,找到干扰病毒周期并保护人类细胞免受损害的药物。
该团队利用此平台已经发现了若干潜在的有效药物,并准备对其中的药物开展临床实验和机理研究。
SARS-CoV-2病毒对人肝细胞的侵染程度及三维定位(细胞核,蓝色-Hoechst 33342染色;脂滴,绿色-HCS lipid Tox Green染色;冠状病毒(SARS-Cov-2),紫红色-核衣壳抗体。)
脂滴在病原微生物感染中的作用
脂滴由极性单磷脂层包裹疏水核心组成,是细胞内诸如三酰甘油、胆固醇酯等中性脂的贮存场所,近年来研究发现,脂滴在病原微生物(如病毒、细菌、寄生虫等)感染细胞过程中发挥着重要的作用,格莱斯顿病毒学和免疫学研究所(GIVI)的研究者们发现:丙型肝炎病毒(HCV)的感染活性需要一个与肝脏脂肪储存相关的酶。这个发现可能提供一个治疗丙型病毒性肝炎感染的新策略。DGAT1是一个帮助脂肪滴形成的酶。Eva Herker博士带领的格莱斯顿的团队发现在缺乏DGAT1活性的肝细胞中HCV感染和病毒颗粒的产生严重受影响。DGAT酶产生储存在脂肪滴中的脂肪,脂肪滴对于HCV复制很重要。Herker博士表示,“HCV特异地依赖一种DGAT酶,即DGAT1。当我们用药物抑制DGAT1时,肝脏通过其他DGAT酶仍然可以产生脂肪滴,但是HCV不能利用这些脂肪滴。”
CQ1用于脂滴相关神经元研究
TAR DNA结合蛋白43 (TDP-43)是在脊髓侧索硬化症等神经退行性病变中会发生异常的蛋白质聚集物,是重要病理学标记,但其聚集的形成方式和驱动核内TDP-43的清除尚未明确。Clevelan研究组发现,在不同细胞系中,定位在细胞核中的TDP-43会形成明显的液-液相分离(LLPS)。随着细胞的衰老,TDP-43在细胞质中积累而形成相分离液滴,液滴会缓慢吸收importin-a和Nup62,导致RanGap1、Ran和Nup107发生错误定位,从而抑制核质转运、清除细胞核TDP-43和诱导细胞死亡。这些发现确定了一种神经元细胞的死亡机制,可由瞬时应激诱导TDP-43突变引起。
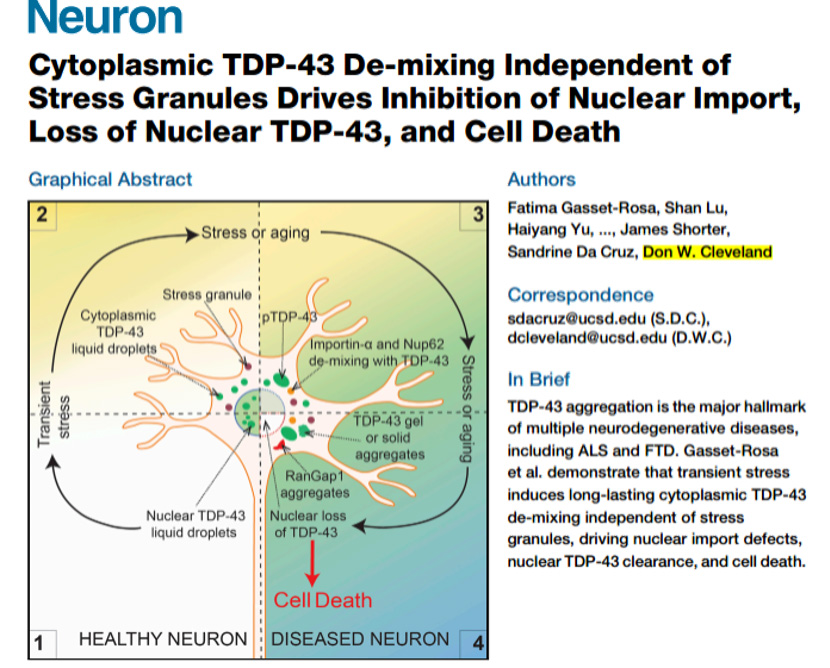
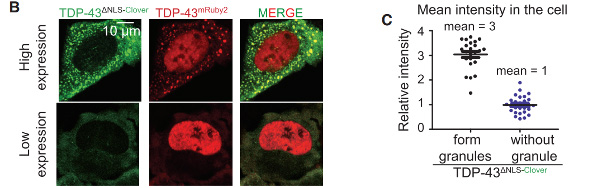
荧光标记的TDP-43在细胞质中形成相分离液滴,观察其融合的动态过程。(B和C)TDP-43删除入核序列(DLS)后,在细胞质内的积累量增加,形成明显的相分离液滴(绿色荧光),并且会招募正常转入细胞核内的TDP-43(红色荧光)。
CQ1在脂滴相关研究中的优势
CQ1高内涵分析系统配备了独家的CSU-W1双转盘激光共聚焦扫描单元。该系统成像清晰,分辨率高,适合于对细胞器,如线粒体、溶酶体及脂滴等微小结构成像,并可对这些微细结构进行多参数的统计分析,此外CQ1成像速度快,适用于高内涵化合物的筛选;光利用率高,低光漂白、低光毒性,系统物镜和图像自动对焦,结合MIP(Maximum Intensity Projection),可对非同焦平面的像素成像,是细胞器等细微结构成像分析利器。
|
